1. 医療機器規制
1.1 規制の目的
医療機器産業が他の産業と大きく異なる点は、規制産業であることです。認可を受けた医療機器のみが市場での流通を許されます。日本では、医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(薬機法)によって規制されています。薬機法は医療機器の開発・製造・流通・広告・表示等の方法について規制されていて、その目的は、第一章総則の(目的)第一条に医薬品、医薬部外品、化粧品、医療機器及び再生医療等製品等の品質、有効性及び安全性の確保と規定されています。
1.2 医療機器規制とQMS
近年の医療機器規制は主に下記の3つの要素から構成されていて、品質マネジメントシステム(QMS:Quality Management System)は医療機器規制の中で不可避なものとなっています。
- 品質マネジメントシステム
医療機器のライフサイクルに関連するQMSを構築、運営します。 - 技術文書
医療機器の医学的有効性と安全性についてQMSに則(のっと)った、検証と妥当性の確認を行い、文書としてまとめます。 - 市販後監視(PMS)
PMS(Post Marketing Surveillance)とは医療機器の販売後、医療機器から得られた経験を収集、分析しQMS並びに医療機器を改善するプロセスです。
QMSは日本では省令169号に準じていますが、これはISO13485 [1]という規格に基づいています。各国でも独自のQMSに関する要求がありますが、これらもISO13485に基づいており、ISO13485が実質的に国際的な医療機器のQMSの標準規格となっています。
以下はISO13485の最新版である2016年版(JIS Q 13485:2018)の基本的な考え方であるプロセスアプローチとリスクベースアプローチについて説明します。
2. ISO13485 : 2016の基本的概念
ISO13485:2016の要求事項を知るうえで、プロセスアプローチとリスクベースアプローチという概念を理解する必要があります。それぞれ、ISO13485:2016の0.序文の0.3にプロセスアプローチおよび4.1.2 b)にリスクベースアプローチに関する記載があります。
2.1 プロセスアプローチ
プロセスアプローチの説明として、ISO13485:2016では
と記載があり、少し難解な表現になっています。
プロセスは、元々既知である情報(インプット情報)に対して、何らかの価値を付加して変化した情報(アウトプット情報)を創生することを意味しており、ソフトウェアでの関数をイメージしていただけると理解しやすいと思います。普段はあまり気にしていないかもしれませんが、一般的な仕事はこのサイクルを繰り返していることになります。
QMSに基づきプロセスを実施するときは、以下の順番で行います。
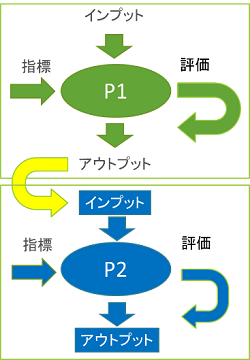
(1)計画書の作成(インプット)
I. 目的の設定
II. 合否判定基準(指標)の設定
(2)計画書に基づいた実行(アウトプット)
(3)実行結果の評価
(4)実行結果の記録
(5)次プロセスへの移行
プロセスは一般的に単独で完結はせずに、一連のプロセスによって完結する場合が多く、この一連のプロセスをシステムと呼んでいます。システムの例として、開発および製品実現のシステム図を以下に示します。
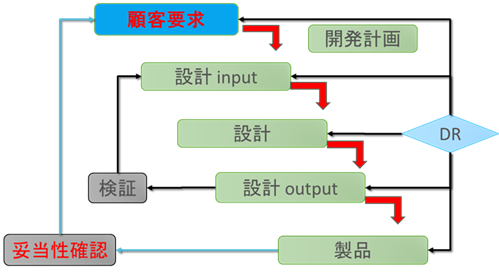
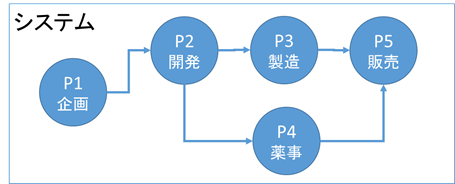
図. システム実施にあたっての開発㊤と製品実現のシステム図
システムでは、それぞれのプロセスのインプットとアウトプットに客観性を持たせるために文書として明確化し、その連続性(トレーサビリティ)を明確化することが求められます。このことからプロセスアプローチでは、プロセスを実施する前の計画段階でアウトプットを予測することが重要となります。
2.2 リスクベースアプローチ
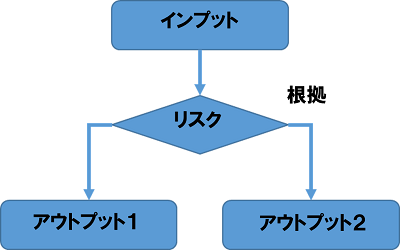
前節で説明したプロセスの実施前に結果を予測する手法としてリスクベースアプローチという手法があり、ISO13485:2016では以下のような記載があります。
リスクベースアプローチの概念も少し難しいのですが、リスクを判断基準として目的や目標の達成を試みる手法になります。リスクベースアプローチの対極的な存在がルールベースアプローチです。これらの概念は主に会計の世界で使用されていますが、医療機器の規制やQMSについても当てはめて考えることが可能で、それぞれを比較すると下表のような特徴があります。

図. リスクベースとルールベースの特徴
ルールベースでは当局より答えが与えられ、その答えに向けて目的や目標を達成するのに対し、リスクベースではQMSや製品に起因するリスクの抽出、分析、低減を企業...