1.実用化待たれるCRISPR(クリスパー)検査
2019年末からジワジワと広がり始めた新型コロナウイルス感染症(COVID-19)は、2020年に入り瞬く間に全世界に広がり、2009年の新型インフルエンザ以来のパンデミックとなりました。新型インフルエンザとは異なり、感染しても症状が現れない感染者(不顕性感染)が多いことから、感染の有無を確実に判定できる検査法が求められ、PCR( polymerase chain reaction )検査が広く適用されることになりました。このため、PCRがどのような手法かが分からなくても、多くの人が毎日のようにPCR検査という言葉を耳にするような状況です。
PCRはとても優れた手法で20世紀最後の革命的発明ですが、このような事態に対応するにはベストな選択肢とはいえません。ここ数年の間に開発され、PCRの代替となり得る手法が実用化されつつあります。本稿では、その中の本命といえるCRISPR検査法について紹介させていただきます。
2.CRISPRとは
CRISPR(clustered regularly interspaced short palindromic repeat)は、1987(昭和62)年に大阪大学(当時)の石野良純博士らによって発見された大腸菌のゲノム上に存在する繰り返し配列です[1]。その後、類似の配列が原核生物に広く存在することが分かり、一種の免疫系を構築していることが判明しました。CRISPRから転写されたRNAをガイドとして、Cas(CRISPR-associated)と呼ばれる一連のタンパク質が、特定の塩基配列を持つDNAやRNAを切断するのが、その主な作用です。ここ数年、毎年ノーベル賞の候補として挙げられているゲノム編集(genome editing)技術は、このうちCRISPR/Cas9系を利用した技術になります[2]。CRISPR/Cas9系を開発した研究者らが、次なるターゲットとして開発を進めたのが、CRISPR診断(CRISPR diagnostics)またはCRISPR検査法(CRISPR test)と呼ばれるものです。これらはいずれもCRISPR系が高感度検出系の一部を構成しているものの、必ずしも中心となる構成要素とは言い切れない部分もあります(図)。
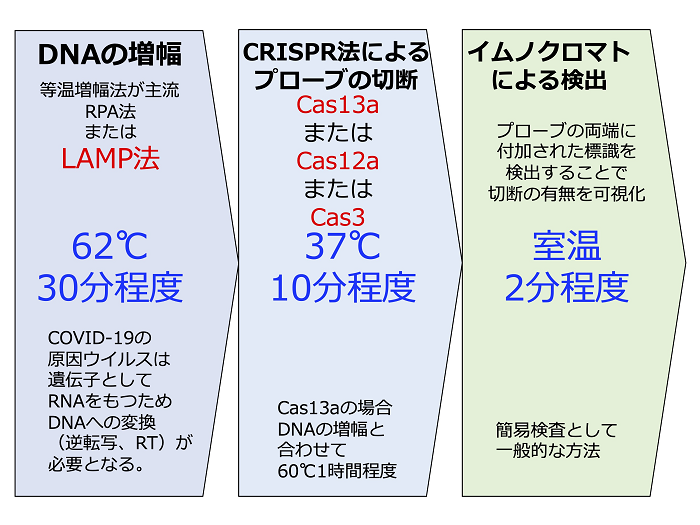
図. CRISPR検査法によるCOVID-19検査の基本的なフロー
3.SHERLOCK(シャーロック)法
SHERLOCK(Specific High sensitivity Enzymatic Reporter unLOCKing)法は、CRISPR/Cas9系の開発者としてノーベル賞ダークホース候補の一人、フェン・チャン(Feng Zhang)博士らが2017年に発表した手法です[3]。同博士が創設したSherlock Biosciences社が、この技術を用いたCOVID-19検査法を開発しています。オリジナルの方法では、試料となるDNAをRPA(recombinase polymerase amplification)法[4]により増幅した後、CRISPR/Cas13a系を用いたコラテラル切断により蛍光プローブ検出を行います。実は、このRPA法がPCR法に代わるDNAの増幅法であり、等温増幅(isothermal amplification)法の一つです。
4.DETECTR(デテクター)法
DETECTR(DNA Endonuclease-TargEted CRISPR Trans Reporter)法は、CRISPR/Cas9系の開発者でノーベル賞最有力候補の一人として名前が挙げられているジェニファー・ダウドナ(Jennifer Doudna)博士らが2018年に発表した手法です[5]。同博士が創設したMammoth Biosciences社が、この技術を用いたCOVID-19検査法を開発しています。オリジナルの方法では試料となるDNAをRPA法により増幅した後、CRISPR/Cas12a系を用いたコラテラル切断により蛍光プローブ検出を行います。使用するCasタンパク質が異なる以外、基本的にはSHERLOCK法と類似しています。
5.CONAN(コナン)法
CONAN(Cas3-Operated Nucleic Acid detectioN)法は、東大医科研の真下博士らが2020年に発表した手法です[6]。同博士が科学技術顧問を務めるC4U社が、この技術を用いたCOVID-19検査法を開発しています。彼らの方法では、試料となるDNAをLAMP(loop-mediated isothermal amplification)法により増幅した後、CRISPR/Cas3系を用いたプローブのコラテラル切断とイムノクロマトグラフィー法(ラテラルフロー法)による検出を行います。LAMP法がPCR法に代わるDNAの増幅法であり、等温増幅法の一つです。実は、これに先だって2020年に発表された他のCOVID-19検査法(SHERLOCK法及びDETECTR法)でもLAMP法とイムノクロマトグラフィー法が採用されています[7][8]。
6.LAMP法
LAMP法は、2000年に日本の栄研化学(株)で開発されたDNAの増幅法です[9]。当時はPCR法に代わるDNAの増幅法が数多く開発されましたが、いずれもそれに取って代わることはできませんでした。LAMP法は、特殊な4種のプライマーを用いる方法で、その原理も極めて難解、PCR法のように気軽に実験系を組み立てられない上に、検出しかできない(定性実験)ということで一部の検査薬にしか利用されていませんでした。しかし、COVID-19のパンデミックという未曾有の事態で、一躍その価値が再評価されるようになりました。PCR法と異なり、等温増幅法であることから安価で簡便な装置でも実施可能というのが最大のメリットです。臨床現場即時検査(point of care testing, POCT)のコア技術として、CRISPR検査とともに今後さらにその利用が広がることが期待されています。
約30年に渡って遺伝子検査のゴールデンスタンダードだったPCR検査。それに代わるかも知れないCRISPR検査。ところがこのコア部分に、20年前に日本で開発され長らく日の目を見なかった技術(LAMP法)が利用されているというのは、とても不思議な感じがします。
8.参考文献
[1] Y, Ishino, et al. Nucleotide sequence of the iap gene, responsible for alkaline phosphatase isozyme conversion in Escherichia coli, and identification of the gene product. J Bacteriol. 169(12):5429-5433.(1987)
[2] M, Jinek, et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337(6096):816-821.(2012)
[3] JS, Gootenberg, et al. Nucleic acid detection with CRISPR-Cas13a/C2c2. Science. 356(6336):438-442. (2017)
[4] O,...





























