ニトロソアミン問題をふまえた洗浄バリデーションと設備共用の可否判断
「ニトロソアミン問題」と毒性学的評価に基づいた、残留許容値の設定方法とは
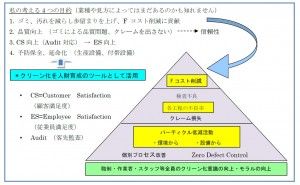
閾値設定が出来ない場合の留意点とは?
受講対象・レベル
全ての医薬品関連企業における経営部門、製造部門、品質部門、試験、薬事、研究開発、医薬品設備設計・エンジニアリング部門、購買、総務、営業、保管物流部門
習得できる知識
・ニトロソアミン問題と洗浄バリデーション
・ニトロソアミン関連製品の設備共用の可否判断
・洗浄バリデーションのリスク管理の重要性
・医薬品製造における3極の洗浄バリデーション
・毒性学的評価に基づく残留許容値の設定と洗浄バリデーション
・PIC/S GMP Annex 15の改定に規定されるダーティーホールドタイム・クリーンホールドタイムのデータ取得・設定・評価方法
・洗浄バリデーション当局指摘事例や、実践事例そして業務の進め方
・高生理活性製造施設の封じ込め技術及びGMPハード要件を知る
・洗浄バリデーションを通し「設備共用に関する規定」を知る
・2021年度改正GMP省令
・2022年版GMP事例集
・ICH Q9、Q10
セミナープログラム
1.洗浄バリデーションにおける3極の法規定について
2.洗浄バリデーションとニトロソアミン問題をふまえた洗浄バリデーションと設備共用の可否判断
2.1 洗浄工程のリスク管理と交叉汚染のリスクアセスメント
2.2 ニトロソアミン問題と毒性学的評価に基づく残留許容値の設定方法
・0.1%基準、10ppm基準、目視限度基準(Eli Lilly社残留基準値の設定根拠)
・PDE(一日暴露許容量)の算出
・EMA暴露限界値設定に関するガイドラインとリスクアセスメント
・NOAEL(無毒性量),NOEL(無作用量),PDE(一日暴露許容値)からの閾値設定
・ICH M7におけるTTC(毒性学的閾値)の適用
・原薬製造工程、製剤包装工程における残留許容限度の算出方法(事例)
・洗浄剤の残留許容基準回収率の設定方法
2.3 情報量の少ない治験薬や毒性不明の新規化合物に対するアプローチ
閾値設定が出来ない場合の留意点
2.4 発がん性データベースTTCによる閾値の設定(ICH M7)
・ニトロソアミン類(NDMA及びMDEA)の管理指標の設定と設備共用の可否判断
- 設備専用化の対象となるもの ?
2.5 ICH M7を踏まえた設備共用可否判断
3.ダーティーホールドタイム(DHT)・クリーンホールドタイム(CHT)の設定と評価方法
4.洗浄バリデーションにおけるサンプリング及び分析法の実施ノウハウ
4.1 スワブ法、リンス法と他の方法(PHなど)の併用
4.2 サンプリング法の妥当性とバリデーション
4.3 分析法バリデーション及び回収率の評価方法
5.3極によるGMP 洗浄バリデーションの査察指摘事例と押さえるべきポイント
・PMDA、cGMP(FDA Warning Letter)、PIC/S(EU)GMP、ICH Q7指摘事例と対策
6.洗浄バリデーション関わる手順書(SOP)及び報告書作成上の留意点
7.医薬品ライフサイクルにおける洗浄手順の構築
・ワーストケースアプローチとグルーピング
8.βラクタム系抗生物質など高生理活性物質やステロイド等製造施設の暴露対策
・封じ込め技術及びGMPハード要件
8.1 原薬GMPガイドライン、PIC/S GMPにおける交叉汚染の防止
8.2 改正GMP省令における交叉汚染防止の新規制
8.3 高生理活性物質製造施設の暴露対策、そして封じ込めとGMPハード要件
8.4 封じ込め設備の設計検討、及び封じ込め性能の検証
8.5 交叉汚染防止と封じ込め設備(2022年版GMP事例集)について
9.高度な封じ込め設備を必要とする高生理活性医薬品(βラクタム系抗生物質などを含む)の洗浄バリデーションと設備共用の可否判断
9.1 固形製剤設備の洗浄バリデーション
9.2 高生理活性化合物製造時の洗浄バリデーション及び設備共用/専用設備化の可否判断
10.まとめ
(一部、内容に変更がある場合がある)
【質疑応答】
セミナー講師
NPO−QAセンター 理事兼事務局長、エイドファーマ 代表 薬学博士 高平 正行 氏
[主な経歴]
1979年4月 塩野義製薬株式会社入社
1994年5月 同 金ヶ崎工場製造管理者、同 製薬研究所
2004年4月~2011年11月 同 信頼性保証本部GMP統括管理グループ長
2011年12月 塩野義製薬退社
医薬品原薬メーカー エースジャパン取締役
2016年6月 エイドファーマ代表
NPO-QAセンター顧問、CMプラス社 提携コンサルタント
2018年5月から現職
[主な研究・業務]
医薬品製造および品質管理、プロセス化学、
品質保証ガイドライン策定、グローバル品質方針策定
国内外GMP規制当局のGMP査察対応、国内外企業のGMP監査(170以上の医薬品製造施設)
GMP関連テーマのセミナー、執筆活動多数を展開中
[業界での関連活動]
特定非営利活動法人医薬品・食品品質保証支援センター(NPO-QAセンター)理事兼事務局長
日本製薬工業会ICHプロジェクト委員会研修
財団法人日本公定書協会研修等
セミナー受講料
1名につき 55,000円(消費税込、資料付)
〔1社2名以上同時申込の場合のみ1名につき49,500円〕
受講について
- 本講座はZoomを利用したLive配信セミナーです。セミナー会場での受講はできません。
- 下記リンクから視聴環境を確認の上、お申し込みください。
→ https://zoom.us/test - 開催日が近くなりましたら、視聴用のURLとパスワードをメールにてご連絡申し上げます。
- セミナー開催日時に、視聴サイトにログインしていただき、ご視聴ください。
- Zoomクライアントは最新版にアップデートして使用してください。
- Webブラウザから視聴する場合は、Google Chrome、Firefox、Microsoft Edgeをご利用ください。
- パソコンの他にタブレット、スマートフォンでも視聴できます。
- セミナー資料はお申込み時にお知らせいただいた住所へお送りいたします。
お申込みが直前の場合には、開催日までに資料の到着が間に合わないことがあります。ご了承ください。 - 当日は講師への質問をすることができます。可能な範囲で個別質問にも対応いたします。
- 本講座で使用される資料や配信動画は著作物であり、
録音・録画・複写・転載・配布・上映・販売等を禁止いたします。 - 本講座はお申し込みいただいた方のみ受講いただけます。
- 複数端末から同時に視聴することや複数人での視聴は禁止いたします。
- Zoomのグループにパスワードを設定しています。
- 部外者の参加を防ぐため、パスワードを外部に漏洩しないでください。
万が一部外者が侵入した場合は管理者側で部外者の退出あるいはセミナーを終了いたします。
受講料
55,000円(税込)/人