核酸医薬品開発のための製造技術移転と非臨床試験段階の構築方法
☆核酸医薬の技術移転と事業戦略についても解説いたします!
☆核酸医薬の製造および品質管理に関する注意点とは?
【アーカイブ配信:9/2~9/11(何度でも受講可能)】での受講もお選びいただけます。希望される方は申込フォームにてご選択ください。
セミナー趣旨
核酸医薬品は「核酸あるいは修飾核酸が十数〜数十塩基連結したオリゴ核酸で構成され、タンパク質に翻訳されることなく直接生体に作用するもので、化学合成により製造される医薬品」であり、アンチセンス、siRNA、アプタマー、CpGオリゴなどがその代表例である。
遺伝子に作用する薬剤として、再生医療等製品のカテゴリーが適用される遺伝子治療も知られるが、これらはいずれも従来の薬剤とは異なる作用機序を持ち、遺伝性疾患の根本治療薬としての期待が高まっている。
本講義ではこうした核酸医薬の研究開発成果を社会実装し、ヒトでの臨床試験に持ち込むうえで要求される規制を整理し、寄り道や後戻りをしない事業開発の方法論についてまとめてみたい。
習得できる知識
〇 核酸医薬の定義と遺伝子治療との違い
〇 核酸修飾体の種類と特許動向
〇 核酸医薬の製造および品質管理に関する注意点
〇 非臨床試験(安全性/毒性試験)に求められる要件
〇 核酸医薬の技術移転と事業戦略
セミナープログラム
1. はじめに
これから核酸医薬事業に参加するために知っておくべきこと
2. 核酸医薬とはどのようなものか?
2.1 核酸医薬の概要
- 核酸医薬品の定義
- 遺伝子治療との違い
- 核酸医薬品の作用メカニズム
- 国内外で承認された核酸医薬品
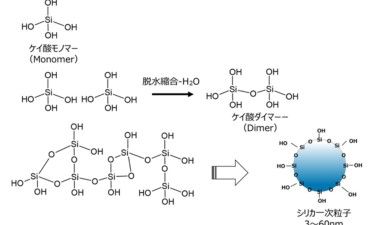
2.2 核酸医薬品の基本構造と核酸の化学修飾体
- 核酸医薬品の基本構造
- 化学修飾体の種類と特許動向
- ドラッグデリバリーシステム(DDS)との組み合わせ
- 国内外で研究開発中の核酸医薬品
3. 核酸医薬品の品質の担保と評価において考慮すべき事項
3.1 責任配列の選定
3.2 主な製造方法(合成、精製)と分析方法
3.3 核酸医薬品の製造(GMP)と受託製造業者(CDMO/CMO)への技術移転
3.4 不純物(目的物質由来、製造工程由来)と残留溶媒・混入汚染物の管理
3.5 特性解析の概要(規格試験、試験方法、安定性試験)と規格設定
3.6 品質保証: GQPならびに変更管理
4. 核酸医薬品の非臨床試験
4.1 非臨床安全性評価に関するガイドライン
4.2 配列に基づく毒性予測: オフターゲット毒性試験
- in silico解析
- in vitroマイクロアレイ解析
4.3 配列に基づかない毒性試験
- 医薬品としてのADME試験等
4.4 動物試験のヒトへの外挿性
5. 核酸医薬品の臨床試験
5.1 臨床試験実施にあたっての調査: 民族的要因の考え方
5.2 グローバル治験の実施で注意すべきこと: CROの選定と実施国の選択
5.3 希少疾病用医薬品開発支援制度(ODD)
5.3 治験薬の製造:原薬GMP、治験薬GMP
5.4 承認申請:CTDの構成と記載要件、CTD-Q: Module3, 2.3の作成 (原薬、製剤)
6. まとめ
ファーストヒューマン試験に向けた準備
【質疑応答】
セミナー講師
合同会社鈴木聡薬業事務所 代表社員 鈴木 聡 氏
【専門】
バイオロジクス、再生医療等製品、希少疾患薬の薬事・品質(RA・QA)および信頼性保証業務
【略歴】
持田製薬株式会社、バイオサイエンス研究所、経営企画室新規事業グループ等
・抗体診断薬、バイオ医薬品、創薬研究企画、臨床開発、製造販売後調査、薬事規制対応
・経営企画室新規事業(ベンチャー投資、機能性食品・化粧品・医療機器等)
YLバイオロジクス株式会社、事業開発・開発薬事部長
・バイオ後続品
オーファンパシフィック株式会社、信頼性保証本部長、総括製造販売責任者
・希少疾患薬、血液製剤・特定生物製剤、遺伝子組み換え医薬品等
サンバイオ株式会社、信頼性保証部、再生医療等製品総括製造販売責任者
・骨髄液由来間葉系幹細胞(MSC)再生医療等製品
Boyd & Moore Executive search
・経営、市場調査。外資日本法人のスタートアップ支援
IPSEN株式会社(仏パリ本社)、設立時代表取締役、総括製造販売責任者
・希少疾患(ウルトラオーファン)、起業・事業計画・製版業取得・ファブレス経営
海和製薬株式会社(中国上海市本社)、Cooperate Office Officer、総括製造販売責任者
・低分子医薬品抗がん剤、中国のバイオ・製薬産業調査
レグセル株式会社(大阪大学発ベンチャー)、Vice President薬事・信頼性保証担当
・抑制性T細胞、がん免疫
2023.10-2024.1
Global Regulatory Partners合同会社(米国籍薬事コンサル会社)、Senir Director RA&QA:
・外国企業の日本参入薬事支援
2024.1-現在
合同会社鈴木聡薬業事務所、代表社員:
・主に大学発ベンチャーの創業・薬事支援。外国CMO会社、薬事コンサル会社の日本パートナー
【社外活動】
PARKS事業化プロデューサー(プレCxO)
・大学発知財の事業化、モダリティ・創薬手法構築、事業計画・IPO等
企業・団体アドバイザー
・国際幹細胞臨床研究会 理事
所属団体個人会員
・再生医療学会、バイオインダストリ協会(JBA)
・臨床試験学会、抗体学会、スクリーニング学研究会
・厚生労働省(MEDISO)、日本CFO協会
セミナー受講料
49,500円(税込、資料付)
■ セミナー主催者からの会員登録をしていただいた場合、1名で申込の場合46,200円、
2名同時申込の場合計49,500円(2人目無料:1名あたり24,750円)で受講できます。
(セミナーのお申し込みと同時に会員登録をさせていただきますので、
今回の受講料から会員価格を適用いたします。)
※ 会員登録とは
ご登録いただきますと、セミナーや書籍などの商品をご案内させていただきます。
すべて無料で年会費・更新料・登録費は一切かかりません。
メールまたは郵送でのご案内となります。
郵送での案内をご希望の方は、備考欄に【郵送案内希望】とご記入ください。
受講について
Zoomを使ったWEB配信セミナー受講の手順
- Zoomを使用されたことがない方は、こちらからミーティング用Zoomクライアントをダウンロードしてください。ダウンロードできない方はブラウザ版でも受講可能です。
- セミナー前日までに必ず動作確認をお願いします。
- 開催日直前にWEBセミナーへの招待メールをお送りいたします。当日のセミナー開始10分前までに招待メールに記載されている視聴用URLよりWEB配信セミナーにご参加ください。
- セミナー資料は開催前日までにお送りいたします。
無断転載、二次利用や講義の録音、録画などの行為を固く禁じます。
受講料
49,500円(税込)/人