無菌医薬品製造所における製造・衛生管理の実務
EC/無菌医薬品の製造(Manufacture of Sterile Medicinal Products)の最終改訂版が発出 こちらにも対応いたします
PIC/S GMP Annex1 second改正案等踏まえ、実務ベースでわかりやすく解説!
セミナー趣旨
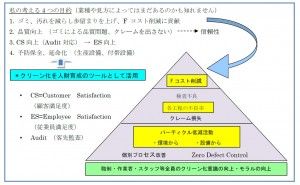
無菌製剤で要請される無菌性・無塵性の保証には、適切な施設設計(ハード対応)ならびに衛生管理(ソフト対応)の設定が必須であり、それらが適切に管理されていることを日常的に継続検証するシステムを構築する必要がある。これが汚染管理戦略(CCS)である。
CCSは、企業の医薬品品質システム(PQS)の一環であり、その実践には品質リスクマネジメント(QRM)が必要である。
CCSの構築にあたっては、PIC/S GMP Annex1(ドラフト)等が参考にはなるが、ガイドラインにすべて網羅されているわけではなく、判断に悩む記述もある。このため、できれば実務経験者の知識・経験を入手することが望ましい。本講は、長きにわたり無菌製剤施設の運営実務に携わった講師による実務に即役立つ講演である。
■本テーマ関連法規・ガイドラインなど
無菌操作法による無菌医薬品の製造に関する指針
最終滅菌法による無菌医薬品の製造に関する指針
Guidance for Industry:Sterile Drug Products Produced by Aseptic Processing-cGMP (2004年)
(USP) chapter. <1116> Microbiological Control and. Monitoring of Aseptic Processing. Environments includes a thorough description, definitions and guidance.(.(2017)
PIC/S-GMPAnnex 1Manufactureof Sterile Medicinal ProductsPE009-92020年(セコンド改正ドラフト)
ISO 13408-1-2 Aseptic Processing of Health care products(2008年)
ISO 14644シリーズ(2015年)
日本薬局方18局参考情報
■講演中のキーワード
・医薬品品質システム
・品質リスクマネジメント
・汚染管理戦略
・プロセスシミュレーションテスト
・環境モニタリング
・製造用水システム
・空調システム
習得できる知識
医薬品品質システムとは
品質リスクマネジメントとは
PIC/S GMP Annex1ドラフトの概要
清浄環境での衛生管理
環境モニタリングの留意点
セミナープログラム
- 医薬品品質システム(PQS)、品質リスクマネジメント(QRM)とは
- PIC/S Annex1改正案のポイント
- 現実の世界(VUCAの世界)では柔軟な思考が必要(OODAループ思考)
- PQSの目的
- 責任役員の責務
- 品質システムはQuality Culture(企業体質)を示す
- Quality Cultureは「重要業績指標(KPI)」に現れる
- そもそも「リスク」とは
- リスクマネジメントの歴史
- 汚染管理戦略(CCS)とは
- 汚染管理戦略の3本柱
- 要請される無菌環境の清浄度
- グレードA~Dと「認証」される微粒子数と製造中の清浄度確認
- 最終滅菌法で要請される環境清浄度
- 無菌操作法で要請される環境清浄度
- CCSは適切な施設設計から始まる
- 作業室の構造(内装、天井)
- 更衣室
- ヒトの衛生管理で知っておきたいこと
- ヒトがいれば発塵する
- 微生物汚染源の頭髪は約50~60本/日抜けている
- 無菌作業の不適格者
- 入室前の点検
- 更衣手順の例
- 過剰な手洗いはさせない
- 無塵衣には洗濯後も異物残留している
- 更衣室は汚い
- プロセスシミュレーションテスト(PST)の実施
- 製造工程管理・環境管理で知っておきたいこと
- ろ過滅菌工程の留意点
- 洗瓶工程の留意点
- ゴム栓洗浄滅菌工程の留意点
- 巻締工程の留意点
- CIP/SIPの留意点
- 日常の環境殺菌事例
- 正しい床掃除法
- 防虫に対する間違った考え(無菌室にも虫が)
- 適切な防虫対策
- 環境モニタリングで知っておきたいこと
- 環境モニタリングの限界を知る
- 環境モニタリングの留意点
- 浮遊微粒子モニタリングの留意点
- アラート/アクションレベルの考え方
- 微生物モニタリング方法(浮遊菌、付着菌、落下菌)の留意点
- 迅速法による微生物測定
- 空調システムで知っておきたいこと
- 日米欧3極の空調要件
- 風速の留意点
- 非作業時と作業時で異なるのは
- スモークスタディの実施
- 用水システムで知っておきたいこと
- 耐熱RO膜の留意点
- 蒸留器の留意点
- TOC計の留意点
- SUSのルージュ化(錆)に注意
<質疑応答>
※活発な質疑は同席した受講者の理解を助けます。
随時受け付けますので基本的な点でも遠慮なくご質問ください。
セミナー講師
医薬品GMP教育支援センター 代表
ハイサム技研 顧問
NPO-QAセンター 作業標準委員会委員
高木肇氏
■経歴
元塩野義製薬株式会社製造本部次長
経口剤の連続生産技術開発や凍結乾燥注射剤の工業化検討、無菌製剤棟の構築プロジェクト遂行、アンプル注射剤・点眼剤製剤包装一貫工場の工場長、中国を始め国内外関連企業への技術支援業務に従事。
退職後は国内および台湾の後発医薬品・医薬部外品・健康食品企業の技術支援、ならびにGMP関連書籍の執筆、講演活動を実施。
出版物として「凍結乾燥のバリデーション」(共著)、「GMP・バリデーション事例全集」(共著)、「現場で直ぐ役に立つ製品標準書作成マニュアル」(共著)、「現場で直ぐ役に立つ 実務者のためのバリデーション手法」(共著)など多数。
セミナー受講料
●受講料:1名44,000円(税込)
1社2名以上同時申込の場合,1名につき33,000円(税込)
●申込締切:2022年9月7日(水)
●講演資料:PDFデータにて配布いたします
主催者
開催場所
全国
受講について
■ご受講の注意事項(予めご了承の上、お申込み下さい。)
・講義中の録音・録画(静止画・動画)行為は固くお断りします。
・お申込いただいていない方と複数名で視聴することを禁じます。
・テキスト資料の無断複製・転載・販売等、一切を禁じます。
・講義中の妨害等、一切の行為を禁じます。
※上記4点、また類似の行為が認められた場合、強制的に退出して頂きます。また、ご本人及びご所属先の方の今後のセミナー参加をお断りします。
・お客様の利用環境、接続環境による不具合について、弊社は一切の責任を負いません。
・必ず視聴テストを行い、接続不良については自社IT部門等に接続についてご確認ください。
ZOOMシステム要件(外部サイト)
ZOOMテストミーティング(外部サイト)
【申込時】
●受講料はセミナー開催5営業日前の15時までにお振込み下さい。
●定員に達し次第、申込を締め切ります。
●最小開催人数3名に満たない場合、中止とさせて頂きます。
●講師及び当社のコンペティターの場合、受講をお断りする場合がございます。
【セミナー当日】
●名刺を以て受講券とします。お忘れなきようご持参ください。
●録音・録画(静止画・動画)行為は固くお断りします。
●会場では講義中のパソコン・携帯電話等の使用をお断りします。
詳しくはこちらをご確認ください。